前列腺癌(Prostate cancer,PCa)是全世界范围内最常见的男性恶性肿瘤之一,近年来,由于生活习惯的改变和医疗水平的不断发展,我国前列腺癌的发病率也在不断升高。由于疾病早期无明显症状,患者发现病情时多处于疾病发展的晚期阶段,且其复发率高,预后差,因此给其治疗带来了一定的挑战。PLK1和Smad4 是前列腺癌发生发展过程中非常重要的两个因子,其中PLK1作为促癌基因,而Smad4作为抑癌基因发挥作用。然而,关于PLK1和Smad4之间的关联,目前没有任何报道。本研究中,该研究团队首次发现PLK1可与Smad4相互作用并促进 Smad4 Thr197的磷酸化,进而诱导Smad4的泛素化及蛋白酶体途径降解。通过免疫共沉淀结合质谱分析筛选出Smad4新的相互作用蛋白PELO,且PLK1/Smad4/PELO三者可形成蛋白质复合物。进一步研究发现,PELO通过与PLK1协同作用促进Smad4的泛素化及降解,从而导致前列腺癌细胞的增殖和转移。
核糖体挽救因子PELO在前列腺癌中的作用并没有任何报道。该研究团队也首次发现PELO在前列腺癌组织中显著上调,且PELO高表达可导致前列腺癌患者预后不良。通过体内和体外实验研究发现,PELO敲低可明显降低前列腺癌细胞的增殖和转移。此外,通过特异性小肽阻断PELO与Smad4的相互作用,可有效抑制前列腺癌细胞在体外和体内的转移能力。总之,本研究揭示了PLK1、Smad4及PELO三者之间新的调控关系,通过共同靶向 PLK1 和 PELO 为转移性PCa的治疗提供了潜在的治疗策略。研究成果于2022年4月发表在肿瘤学领域高水平期刊Oncogene,高平教授为该论文的第一作者及通讯作者,硕士研究生郝敬兰、谢倩文为共同第一作者,beat365官网教师董小明为共同通讯作者。陕西师范大学为论文第一署名单位。
论文链接:https://www.nature.com/articles/s41388-022-02316-8
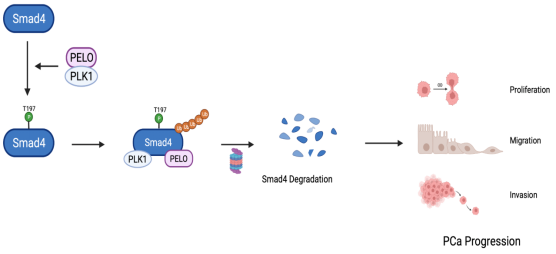
图1. PELO协同PLK1调控Smad4的模式图
全基因组关联分析(GWAS)已鉴定出大量与疾病相关的SNP位点,但大多数SNPs的具体生物学功能并不清楚。本研究中,我们首先利用关联分析探究了不同人群中前列腺癌与SNP位点rs2853669之间的风险相关性。结果表明,不同人群中前列腺癌的风险等位基因不同。进一步研究发现,转录因子E2F1和c-MYC可特异性结合rs2853669的不同等位基因,进而上调TERT的表达水平。临床数据表明 MYC/E2F1/TERT的表达水平与 rs2853669 的TT和CC 基因型对PCa预后和恶性程度存在协同作用。综上,本研究揭示了rs2853669影响PCa发生发展的具体分子机制,为PCa的临床诊治提供了新的理论基础。研究成果于2021年11月发表在肿瘤学领域期刊Frontiers in Oncology,beat365官网教师董小明与硕士研究生郝敬兰为该论文的共同第一作者,高平教授为论文的通讯作者。陕西师范大学为论文第一署名单位。
论文链接:https://www.frontiersin.org/articles/10.3389/fonc.2021.754206/full
CRISPR/Cas9是一种高效、准确且可优化的基因组编辑工具。本研究中,我们提出了一种优化的CRISPR/Cas9基因编辑方法,可用于贴壁细胞系中单核苷酸的突变。该研究论文描述了如何在前列腺癌细胞系22Rv1 细胞中产生单核苷酸突变的方法。研究成果于2021年6月发表在Cell旗下子刊STAR Protocols,高平和董小明为该论文的共同第一作者,高平教授为论文的共同通讯作者。陕西师范大学为论文第一署名单位。
论文链接:https://www.sciencedirect.com/science/article/pii/S266616672100126X?via%3Dihub

